Тема урока «Оксиды азота. Азотная кислота»
|
Генсюр Анна Владимировна учитель высшего уровня квалификации первой категории Лебяжинская средняя школа, район М.Жумабаева СКО |
Класс: 10
Оборудование: карточки с заданиями, схемы (
Цель: На основе знаний об азоте изучить свойства оксидов азота, азотной кислоты, особенности взаимодействия концентрированной азотной кислоты с металлами.
Вводимые понятия: селитры, нитриты, нитраты, «царская водка»
Методы и методические приемы:
- словесный;
- наглядный;
- работа с доской;
- работа с таблицей;
- работа с тетрадью.
Ход урока:
- Проверка знаний учащихся по теме прошлого урока
- Изучение нового материала
- Закрепление изученного материала
- Домашнее задание
I. Организационный момент. Проверка домашнего задания
В воздухе он главный газ,
Окружает всюду нас.
Угасает жизнь растений
Без него, без удобрений.
В наших клеточках живет
Важный элемент… (азот)
Дайте общую характеристику азоту по положению в Периодической таблице химических элементов
С какими веществами азот вступает в химические реакции.
Закончите уравнения химических реакций по схемам (у доски 2 ученика выполняют задание остальные работают в тетради)
Ca + ? = Ca3N2
? + F2 = NF3
NH3 + ? = NH4OH
Ag2O + NH3 = ? + Ag + ?
NH4NO3 + ? = ? + NH3 + H2O
NH4Cl = ? + ?
II. Объяснение нового материала
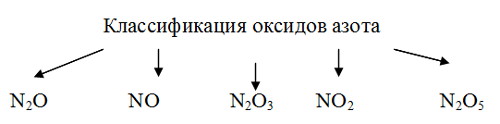
Под каждой формулой в столбик запишите основные физические свойства, используя материал параграфа учебника.
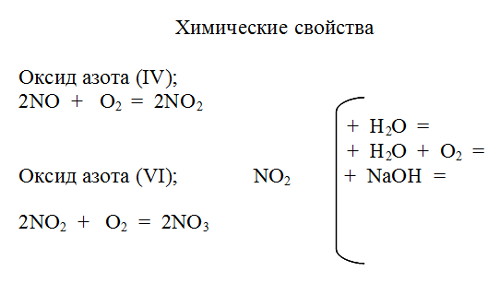
Уравнения реакций, используемые при написании химических свойств оксидов азота и азотной кислоты.
2 NO2 + H2O = HNO3 + HNO2 (азотистая кислота)
4NO2 + 2H2O + O2 = 4HNO3
2NO2 + 2NаOH = NaNO3 + NaNO2 + H2O
Азотная кислота и её соли
А. Полная диссоциация в водном растворе (запишите уравнение реакции)
Б. Разложение на оксид азота (IV), кислород и воду
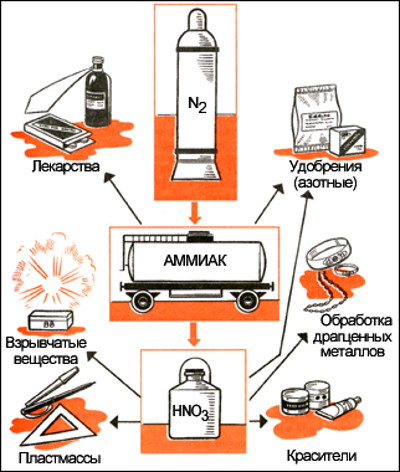
В. Концентрированная азотная кислота реагирует со всеми тяжёлыми Ме, кроме железа, хрома, алюминия, золота, платины, иридия, родия, палладия с выделением бурого удушливого газа. Ювелиры отличают чистое золото от его сплавов с медью с помощью азотной кислоты. От капли азотной кислоты на поверхности меди появляются пузырьки бурого газа — оксида азота (IV) NО2. (лисий

Г. Концентрированная азотная кислота при взаимодействии со щелочными и щелочноземельными металлами выделяет газ N2O
Д. Разбавленная азотная кислота реагирует со щелочноземельными металлами, а также с цинком и железом, при этом образуется аммиак и нитрат аммония (NH3; NH4NO3)
Е. Разбавленная азотная кислота реагирует с тяжёлыми Ме, при этом выделяется NO.
Приведём примеры уравнений химических реакций:
А. Концентрированная: Au + 2HNO3 = AgNO3 + NO2 + H2O
Zn + 4 HNO3 = Zn(NO3)2 + 2 NO2 + 2H2O
S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
Б. Разбавленная: 3Ag + 4 HNO3 = 3AgNO3 + NO + 2 H2O
S + 6HNO3 = H2SO4 = 2NO
В литературе вы можете встретить понятие «царская водка» — это смесь 1 части концентрированной азотной кислоты с 3 частями концентрированной соляной кислоты, которая способна растворит даже платину.
III. Закрепление изученного материал
Самостоятельная работа
1. привести реакции получения азотной кислоты из:
1 вариант Азота.
2 вариант Аммиака.
2. Закончить уравнение реакции:
1 вариант Cu + HNO3(конц.) =
2 вариант Cu + HNO3(разб.) =
3. Перечислить все оксиды азота известные вам
1 вариант привести их классификацию и дать им названия
2 вариант определить степень окисления азота в оксидах
4. Осуществить цепочку превращений.
a) Вариант В
b) Вариант Дать названия полученным веществам
NO2 → HNO3 →Zn(NO3)2 →O2
IV. Домашнее задание:
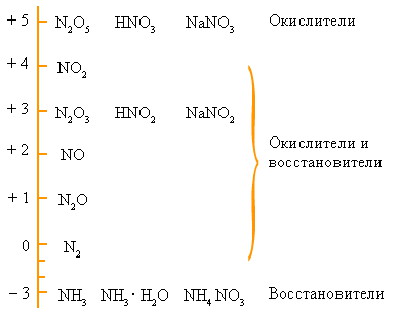
Используя схемы рассказать о
- 15999 просмотров