Урок химии в 8 классе «Озон — защитник планеты»
|
Чернявский Дмитрий Павлович учитель химии 1 категории Ильичевской СШ, Тайыншинский район СКО |
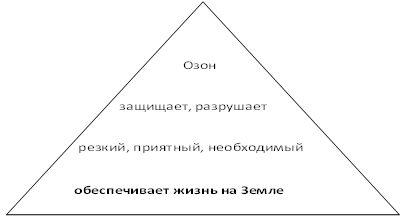
Озон обеспечивает жизнь на Земле!!!
Цели урока: изучить нахождение озона в природе. Первичное осознание аллотропии. Простое вещество озон-осмысление связей и отношений в объектах изучения.
Задачи урока:
Образовательные: изучение свойств простого вещества озон; обобщение полученных ранее знаний об озоновом слое; знакомство с понятием аллотропия, с физическими и химическими свойствами озона.
Развивающие: формирование реальной химической картины мира для понимания основных химических закономерностей; возможных способов решения экологических проблем средствами химии; развитие познавательных интересов и интеллектуальных способностей в процессе проведения химического эксперимента, самостоятельного приобретения знаний; формирование представлений о зависимости свойств от состава вещества; о классификации как общенаучном приеме;
Воспитательные: воспитание экологической грамотности; понятия о единстве мира веществ и процессов в природе и промышленности.
Тип урока: урок изучения и первичного закрепления новых знаний
Учебно-методическое обеспечение и ТСО:
1) Оборудование и реактивы: озонатор, вода, концентрированная серная кислота, пероксид бария
2) Таблица «Периодическая система химических элементов Д.И. Менделеева»
3) Таблица «Растворимость кислот, солей, оснований»
Ход и содержание урока
I. Организация класса. (Приветствие ребят)
Здравствуйте, уважаемые ребята! Я рад вас приветствовать на сегодняшнем уроке. Желаю всем хорошего настроения, удачи, успехов, ярких впечатлений. Тогда в добрый путь!
Улыбнемся друг другу!
Сегодня мы проведем с вами урок химии по теме «Озон — защитник планеты»
Перед нами стоит цель: изучить нахождение озона в природе. Первичное осознание аллотропии. Простое вещество озон — осмысление связей и отношений в объектах изучения.
II. Проверка домашнего задания и подготовка учащихся к активному и сознательному усвоению нового материала
Проводится в виде игры «Брейн ринг»
Класс делится на три группы, каждая команда придумывает себе названия.
1 раунд. Разминка 1. Химический диктант
1. Какой химический знак присвоен кислороду? (О)
2. Как определить заряд ядра? (по порядковому номеру химического элемента)
3. Почему заряд ядра имеет знак «+»? (в ядре находятся протоны)
4. Как найти число протонов? (число протонов определяет заряд ядра)
5. Как найти число электронов? (равно числу протонов)
6. Как найти число нейтронов? (из относительной атомной массы отнять число протонов)
7. Почему число протонов равно число электронов? (заряд атома в целом электронейтрален)
8. С какого уровня начинается заполнение электронной оболочки? (с первого)
9. Какие вещества называют простыми
10. Приведите примеры простых веществ
2 раунд. Эстафета. Заполнить таблицу
Характеристика элемента кислорода (с каждой команды выходит по одному ученику и заполняют таблицу)
|
Знак |
Аr |
M |
Период |
Группа |
Валентность |
|
S O H K F C P |
|
|
|
|
|
3 раунд. Байга. Быстро и верно
(Какая команда раньше ответит на вопрос)
1. Молярная масса воздуха?
2. Кто открыл кислород?
3. Мельчайшие, химически неделимые частицы молекулы?
4. Способность атома химического элемента присоединять определенное число атомов другого элемента.
5. Валентность натрия?
6. Кто сформулировал закон постоянства состава веществ? (Ж. Прустом)
7. Кто сформулировал закон сохранения массы веществ? (Ломоносов М.В.)
8. «Кислород» в переводе с латинского означает.(рождающий кислоту)
9. Химический знак кислорода (О)
10. Сколько кислорода в атмосфере нашей планете по объему (21%)
11. В промышленности кислород получают из (воздуха)
12. Бинарное соединение состоит из двух элементов, одним из которых является кислород (оксид) 13. Кто открыл кислород? (Шееле, Пристли)
13. Кто дал название кислороду Oxyqenium? (Лавуазье)
14. В1774 году английский ученый Д.Пристли, получил кислород разложением (оксида ртути).
III. Путешествие в мир нового вещества — озон. (Изучение нового материала)
Проводится в форме беседы с учащимися. По ходу работы делаются соответствующие записи в тетрадь.
Учитель: Как приятно прогуляться после грозы. Воздух чист и свеж.
Постановка проблемы: Часто говорят в таких случаях: «Озоном пахнет. Очень полезно для здоровья». Так ли это? А что мы знаем об удивительном веществе — озоне, его свойствах, о его роли в природе, в жизни человека. Озон в переводе с латинского означает — «пахнущий». Концентрация озона растёт с удалением от поверхности Земли и максимум его на высоте 20-25 км. — это «озоновый слой» или «озоновый щит», который не пропускает к поверхности Земли жесткие ультрафиолетовые лучи. Озон обеспечивает жизнь на Земле!!! Разрушение «озонового слоя» образует «озоновые дыры». Через эти «озоновые дыры» ультрафиолетовые лучи доходят до Земли, которые могут быть опасны для здоровья. Солнечная радиация вызывает тяжелые ожоги кожи, может вызывать «рак» кожи, а также слепоту. Полное отсутствие в воздухе озона даёт неблагоприятные последствия, т.к. это снижает бактерицидные свойства воздуха: увеличивает содержание в нём микроорганизмов и даёт неприятные запахи. Но если в воздухе содержания озона 8,9 мкг/л, то отёк легких и смерть.
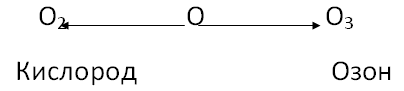
На этом уроке мы более подробно ознакомимся с этим веществом. Озон был открыт в 1785 г. — Ван-Маррумом, он получил его из О2 действием электрических искр. Теперь давайте ознакомимся с молекулярной формулой озона О3.

В состав озона входит элемент кислород, этот же кислород входит и в вещество кислород такое явление в химии называется аллотропией.
Явление, при котором один химический элемент может образовывать несколько разных простых веществ, называется аллотропией. Такие простые вещества являются аллотропными видоизменениями данного элемента.
Опыт: получение озона:
1. Способ взаимодействие концентрированной серной кислоты с пероксидом бария
3BaO2 + 3H2SO4 = 3ВаSО4 + 3H2O + O3
2. Способ озон получают в озонаторах, действуя на кислород электрическим разрядом высокого напряжения.
3. О2 →электрический разряд→2О3
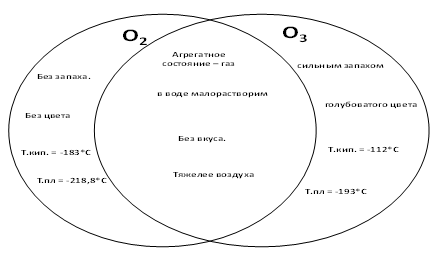
IV. Составление диаграммы Венна
Физические свойства озона в сравнении с кислородом
Химические свойства.
Молекула озона очень непрочная О3—> О2 + О

Применение озона.
а) предотвращения порчи пищевых продуктов в холодильниках;
б) для озонирования воздуха в обитаемых помещениях с целью улучшения общего; состояния и повышения работоспособности работающего персонала;
в) для дезодорации воздуха в животноводческих помещениях;
г) в очистных сооружениях в качестве дезодоранта;
д) для дезинфекции водных источников и плавательных бассейнов;
е) применения озона в целях стерилизации плазмы крови и вакцин;
ж) для газовой стерилизации хирургических инструментов и аппаратов в условиях клиник и промышленных предприятиях;
з) уничтожение неприятного запаха у жиров и масел;
IV. Закрепление новых знаний
Ребята, а теперь я предлагаю вам блиц-опрос для закрепления знаний, полученных на сегодняшнем уроке.
Блиц-опрос. (в виде фронтального опроса.)
1. Когда был открыт озон?
2. Кем был открыт озон?
3. Сколько атомов кислорода входит в состав молекулы озона?
4. Что такое аллотропия?
5. Какой цвет имеет озон?
6. На каком расстоянии от земли находится озоновый слой?
7. Молекулярная масса озона
8. На каком расстоянии от земли наибольшая концентрация озона?
9. Что такое озоновый слой? От чего он защищает землю?
10. Где можно использовать озон?
11. Дидактическая задача: закрепить умения об уравнениях реакций растравления коэффициентов (уравнять уравнения реакций).
Cu+O3=CuO
Ca+O3=CaO
S+O3=SO2
NO2+O3—>N2O5
PbS + O3 = PbSO4+ O2
H2O2 + O3 = H2O + O2
4KOH + O3 = KO3 + O2 + 2H2O
Составление Синквейна (пирамиды). Задание: каждая группа составляет пирамиду по опорным словам, состоящую из 1 существительного, 2 глаголов, 3 прилагательных, фразы
V. Рефлексия
Насколько актуально изучение озона в наши дни?
VI. Итоги урока
VII. Домашнее задание (каждому учащемуся дается карточка).
Заполните таблицу
|
Элементы сравнения |
Кислород |
Озон |
|
1.Химическая формула |
|
|
|
2. Молекулярная масса |
|
|
|
3. Агрегатное состояние |
|
|
|
4. Цвет |
|
|
|
5. Запах |
|
|
|
6. Плотность |
|
|
|
7. Температура кипения |
|
|
|
8. Химическая активность |
|
|
- 12106 просмотров